Содержание
В глобулярные белки представляют собой белки, которые имеют третичную структуру, в которой пептидные цепи расположены в глобулярной конформации. К этой группе относится большая часть клеточных белков, которые являются наиболее важными белками с ферментативной активностью.
Белки представляют собой молекулы особого типа в клетках, из которых состоит все живое. Его структура состоит из комбинации 20 аминокислот, которые повторяются в разных пропорциях и соединены химическими связями в генетически определенном порядке или последовательности.
Они чрезвычайно многочисленны и выполняют важные функции со многих точек зрения клеточной жизни до такой степени, что без них существование жизни в том виде, в каком мы ее знаем, было бы невозможно.
Каждый вид живых существ на Земле имеет определенный набор белков, и, кроме того, у многоклеточных организмов есть клетки, которые отличаются друг от друга в основном белками, которые они производят.
Какие бывают белки
По строению
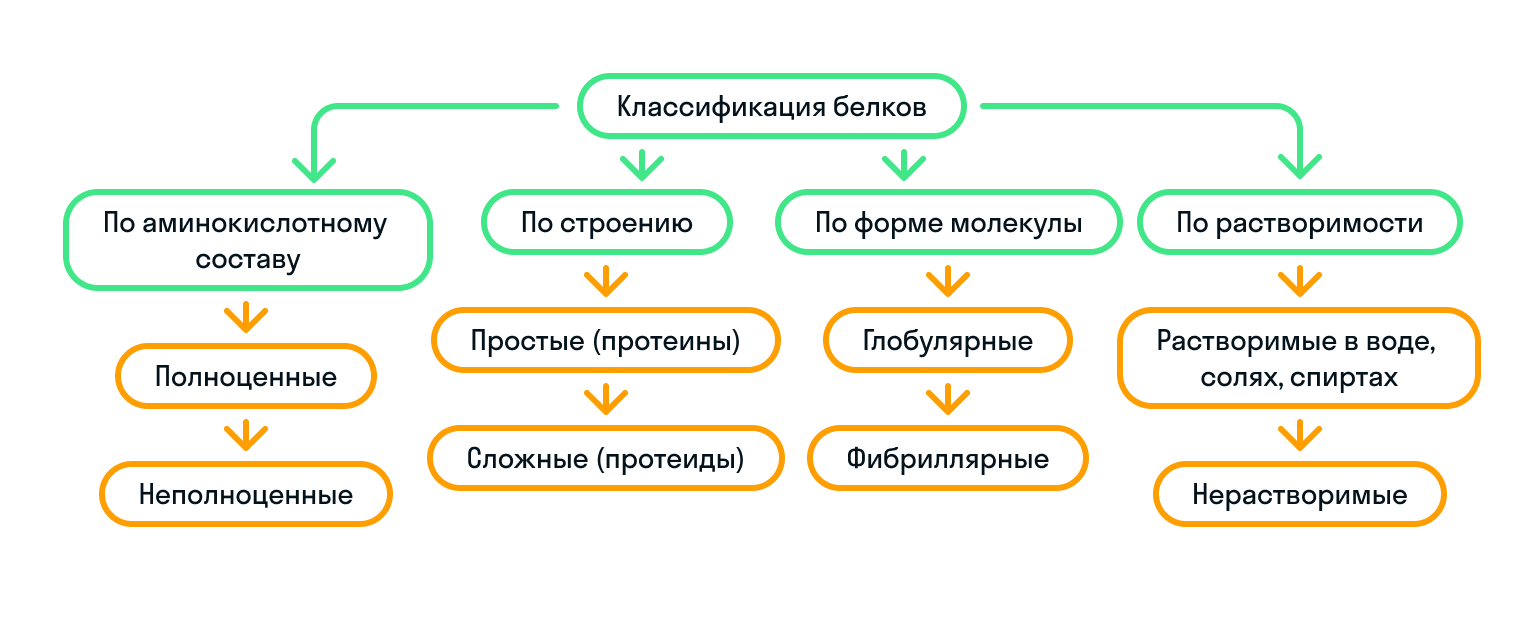
По строению белки делятся на простые (протеины) и сложные (протеиды):
-
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
-
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
-
форма молекулы глобулярных белков — глобула (сфера или эллипс). Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
-
форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
-
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
-
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Важность белка для здоровья человека: дефицит белка
Дефицит белка вызывает квашиоркор (угнетение роста и созревания, гипоальбуминемия, апатия, анорексия, изменения кожи, напоминающие пеллагру, жировая инфильтрация печени).
Дефицит белков особенно опасен для детей (они вызывают задержку роста и умственного развития, похудание) и беременных женщин (белок необходим для правильного роста и развития плода, для выработки большего количества крови для матери и ребенка).
Недополучение белков в утробе матери и у младенцев тормозит физическое и умственное развитие и повышает восприимчивость к инфекционным заболеваниям. Во время грудного вскармливания белок составляет основу увеличения производства молока.
В случае дефицита белка в пище подавляются или нарушаются многие обменные процессы, анемия, иммуносупрессия, атрофия мышечной ткани, дегенеративные изменения органов, общая слабость, апатия и потеря работоспособности.
Дефицит белка может быть следствием не только его недостатка или недостаточного поступления в пищу, но также его неправильного усвоения и усвоения (например, при заболеваниях печени и почек, хронической диарее).
Коллаген
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
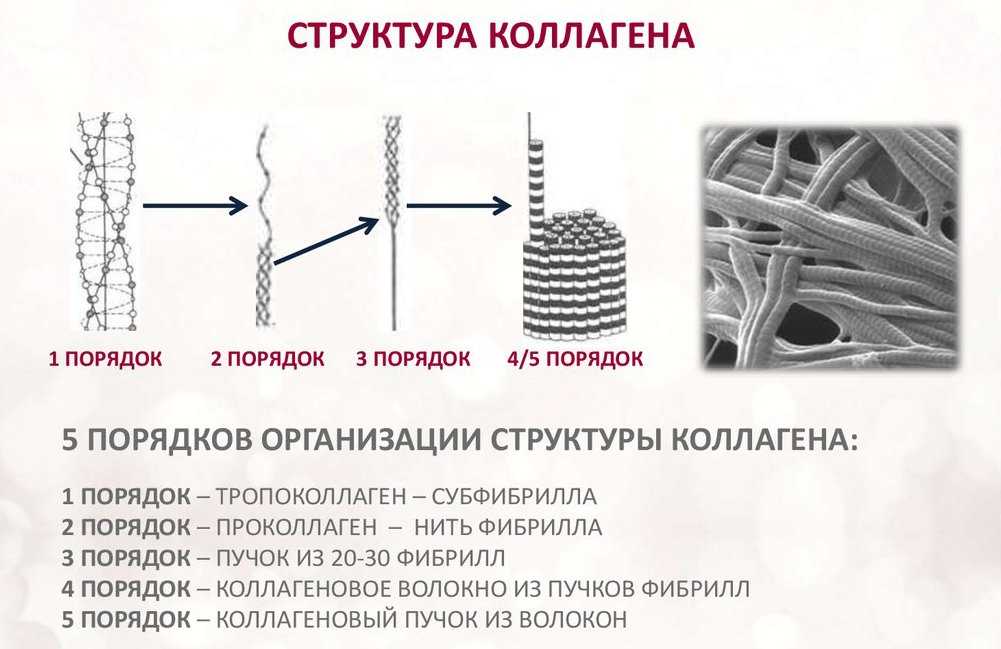
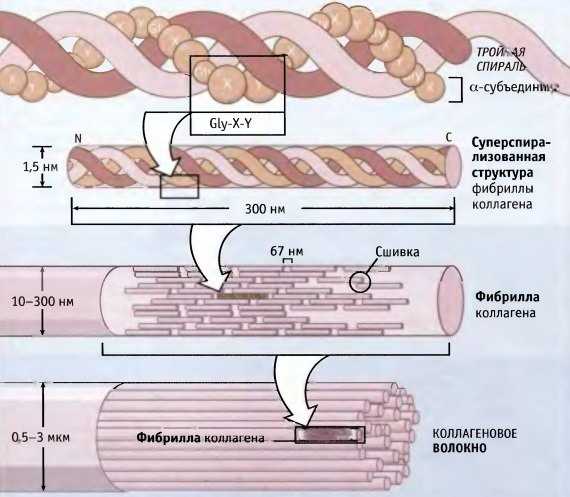
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.
Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Основные отличия нитевидных белков от сферических
Кроме пространственной формы, фибриллярные белки отличаются от глобулярных по:
- размеру;
- растворимости;
- функциям.
Волокнистые протеины обычно крупнее сферических и представляют собой длинные стержни, сформированные из спиралей. В отличие от глобулярных белков, пространственная конформация фибриллярных обеспечивается за счет сильных водородных связей. По этой причине волокнистые протеины более стабильны и не так легко денатурируют, как сферические.
В отличие от глобулярных белков, фибриллярные:
- не растворяются в воде, а также слабых кислотах и основаниях;
- растворимы в сильных щелочах и кислотах;
- обладают свойствами растяжимости и сжатия;
- характеризуются высокой устойчивостью к пищеварительным ферментам.
Глобулярные белки построены из прямых участков вторичных структур, которые при соединении друг с другом резко меняют направление, формируя трехмерный клубок. Волокнистые протеины состоят из одного элемента, повторяющегося много раз.
Общая характеристика пространственной структуры белка
В первоначальном виде синтезированный белок представляет собой линейную цепочку аминокислот, соединенных друг с другом пептидными связями. Однако на пути к конечной функциональной форме молекула претерпевает несколько стадий пространственной укладки за счет различных химических взаимодействий. Каждый этап формирования обозначен соответствующими структурами: первичной, вторичной, третичной и четвертичной (если имеется).
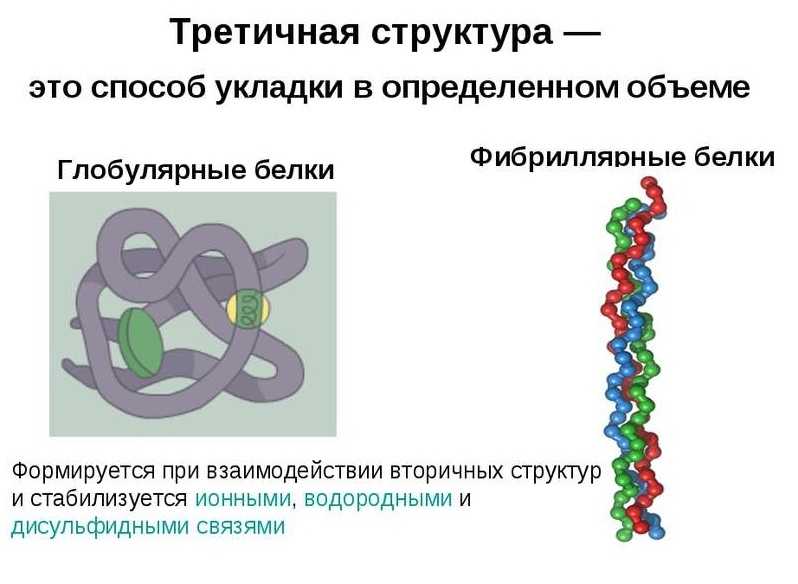
Глобулярные белки характеризуются трехмерной пространственной конформацией, которая удерживается комплексом слабых химических связей (водородные, ионные, гидрофобные и т. д.). По форме молекула такого протеина напоминает сферический клубок.
Полипептидные цепи фибриллярных белков формируют длинные волокна, которые состоят из повторяющихся элементов вторичной структуры. Устройство третичной конформации нитевидных протеинов по сравнению с глобулой значительно примитивнее, однако обеспечивает хорошую стабильность.
ТОП-10 малоизвестных фактов о белке

Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
С чем сочетать продукты, содержащие белок
Мясо требует максимума желудочного сока. На переваривание и усвоение белковой пищи влияют жиры, сахара, кислоты. Поэтому из рациона питания исключают некоторые сочетания.
Жирная пища плохо сочетается с белковой. Жир увеличивает время переваривания, замедляет выделение желудочного сока. Допускается сочетать белковые продукты животного происхождения с животными жирами, растительного происхождения – с растительными жирами.
Желудочную секрецию ускоряет свежая зелень, овощи.
Выделение желудочного сока замедляет пища с высоким содержание сахаров, поэтому ее не сочетают с белковыми продуктами.
Секрецию желудочного сока замедляет кислая еда, она мешает переваривать белок.
Продукты, содержащие белок, полезно сочетать с некрахмалистой пищей и овощами: капустой, кабачками, огурцами, луком, сельдереем, редисом, петрушкой. Такое меню способствует перевариванию пищи, быстрому удалению из кишечника вредных соединений.
Не стоит включать в рацион одновременно белковую пищу и свеклу, репу, тыкву, морковь, картофель.
Молоко лучше употреблять отдельно, само по себе.
Усвоению белка способствуют живая еда без тепловой обработки.
Не стоит сочетать две и больше разновидности продуктов, содержащих белок. У них разные химические составы, которые требуют для расщепления своих ферментов. Например, не сочетать мясо и рыбу, сыр и орехи, мясо и яйца, мясо и молоко, мясо и сыр.
Продукты, содержащие белок, представлены в Таблице 1:
| Название | Содержание белка в 100 г продукта, г |
|---|---|
| Зерновые, бобовые | |
| Горох | 20,5 |
| Фундук | 16,1 |
| Крупа гречневая | 13 |
| Дрожжи | 12,7 |
| Пшено | 12 |
| Овсяные хлопья «Геркулес» | 11 |
| Крупа овсяная | 11 |
| Крупа кукурузная | 11 |
| Макароны | 10,4 |
| Крупа ячневая | 10 |
| Мука | 10 |
| Батон | 8 |
| Хлеб пшеничный | 7,6 |
| Крупа рисовая | 7 |
| Черный хлеб | 6,5 |
| Молочные продукты | |
| Сухое молоко | 26 |
| Сыр голландский | 26 |
| Российский сыр | 23 |
| Нежирный творог | 18 |
| Брынза | 17,9 |
| Жирный творог | 14 |
| Плавленый сыр | 8,4 |
| Сгущенное молоко с сахаром | 7,2 |
| Молоко коровье | 3,2 |
| Сметана 10% жирности | 3 |
| Жирный кефир | 2,8 |
| Сливки | 2,8 |
| Сливочное масло | 1,3 |
| Жирная пища | |
| Майонез «Провансаль» | 2,8 |
| Сливочный маргарин | 0,3 |
| Растительная пища | |
| Чеснок | 6,5 |
| Горошек зеленый | 5 |
| Белые грибы свежие | 3,7 |
| Петрушка | 3,7 |
| Капуста кольраби | 2,8 |
| Укроп | 2,5 |
| Картофель | 2 |
| Редька | 1,9 |
| Изюм | 1,8 |
| Капуста белокочанная | 1,8 |
| Лук репчатый | 1,7 |
| Бананы | 1,5 |
| Репа | 1,5 |
| Свекла | 1,5 |
| Лук зеленый | 1,3 |
| Морковь | 1,3 |
| Перец сладкий | 1,3 |
| Баклажаны | 1,2 |
| Редис | 1,2 |
| Помидоры | 1,1 |
| Черная смородина | 1 |
| Абрикосы | 0,9 |
| Апельсины | 0,9 |
| Вишня | 0,8 |
| Огурцы | 0,8 |
| Арбуз | 0,7 |
| Клюква | 0,5 |
| Яблоки | 0,4 |
| Виноград | 0,4 |
| Мясо и рыба | |
| Тунец | 24 |
| Мясо кролика | 21 |
| Говядина | 19 |
| Ставрида | 18,5 |
| Курятина | 18,2 |
| Кальмар | 18 |
| Печень говяжья | 17,9 |
| Почки говяжьи | 17,9 |
| Вареная колбаса | 17 |
| Баранина | 16 |
| Карп | 16 |
| Консервированные сардины в масле | 16 |
| Сердце говяжье | 16 |
| Треска | 16 |
| Говяжье легкое | 15,2 |
| Свинина тушеная | 14,9 |
| Колбаса вареная «Докторская» | 12,8 |
| Яйцо куриное | 12,7 |
| Печень трески | 4,2 |
| Другие продукты | |
| Кофе в зернах | 13,9 |
| Какао-порошок | 12,9 |
| Шоколад | 5,4 |
| Пирожное с кремом | 5 |
| Мороженное | 3,3 |
Кератины
Выделяют 2 основных разновидности кератинов: альфа и бета. В первую группу входят волокнистые белки, входящие в состав покровных образований позвоночных. Альфа-кератины составляют большую часть сухой массы:
- эпидермиса;
- волос и шерсти;
- когтей и ногтей;
- копыт, рогов, панцирей, игл и т. д.
Иными словами, кератины альфа-группы являются структурной основной для формирования производных кожи. Бета-разновидность этого типа волокнистых белков входит в состав паутины и шелка. Эти кератины более мягкие.
Жесткие белки альфа-группы выполняют защитные функции, а также обеспечивают прочность определенных анатомических частей (рога, копыта, клювы). За счет кератина происходит образование мозолей на поврежденной коже.
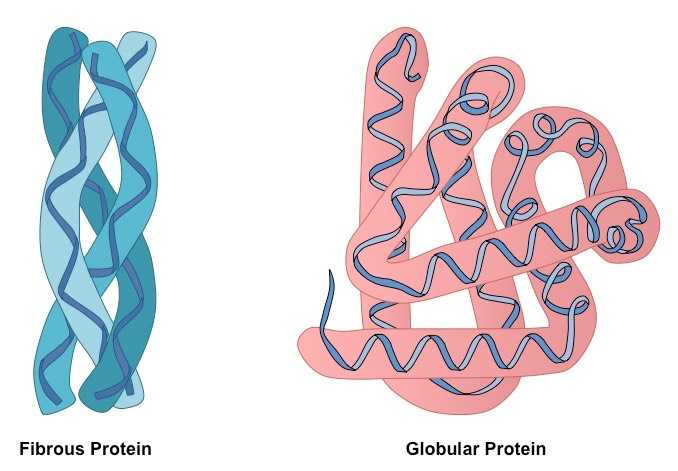
Примеры фибриллярных и глобулярных белков
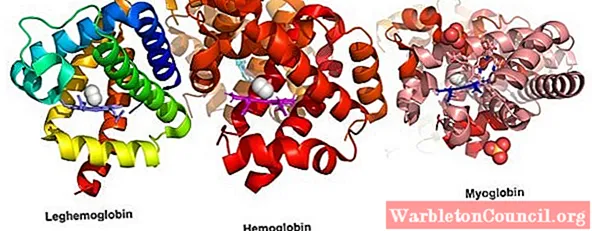
К глобулярным белкам можно отнести все протеины, растворенные в межклеточной и внутриклеточной средах, а также в плазме крови. Сюда относят ферменты, белковые гормоны, факторы транскрипции, иммуноглобулины и так далее. Классическим образцом глобулярного белка можно назвать гемоглобин.
Сферические протеины выполняют множество функций, тогда как волокнистые — только структурную. Типичным примером фибриллярных белков являются коллаген, эластин и кератины. К группе волокнистых протеинов относят также фиброин, из которого состоит шелковая нить, и фибрин, формирующийся при полимеризации фибриногена в процессе свертывания крови.
Общая характеристика пространственной структуры белка
В первоначальном виде синтезированный белок представляет собой линейную цепочку аминокислот, соединенных друг с другом пептидными связями. Однако на пути к конечной функциональной форме молекула претерпевает несколько стадий пространственной укладки за счет различных химических взаимодействий. Каждый этап формирования обозначен соответствующими структурами: первичной, вторичной, третичной и четвертичной (если имеется).
Глобулярные белки характеризуются трехмерной пространственной конформацией, которая удерживается комплексом слабых химических связей (водородные, ионные, гидрофобные и т. д.). По форме молекула такого протеина напоминает сферический клубок.
Полипептидные цепи фибриллярных белков формируют длинные волокна, которые состоят из повторяющихся элементов вторичной структуры. Устройство третичной конформации нитевидных протеинов по сравнению с глобулой значительно примитивнее, однако обеспечивает хорошую стабильность.
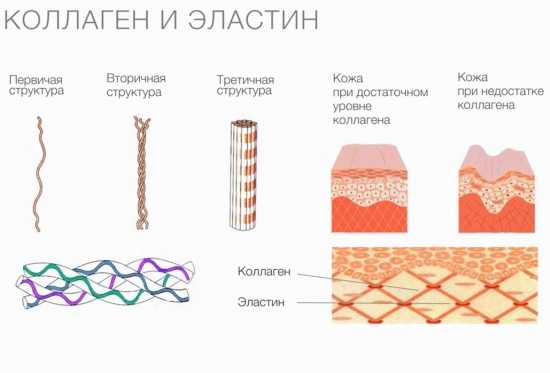
Коллаген
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.
Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Третичная и четвертичная структура
Третичная структура глобулярных белков формируется спонтанно и поддерживается взаимодействиями между аминокислотными цепями, из которых они состоят.
Это компактная полусферическая форма, настолько компактная, что очень напоминает кристалл. Это определяется взаимодействиями, существующими между различными вторичными структурами, которые могут существовать в одной и той же полипептидной цепи.
Было установлено, что силы, поддерживающие взаимодействие между этими цепями, обычно имеют слабую природу, например ван-дер-ваальсовы взаимодействия между наиболее гидрофобными аминокислотами (аполярные связи) или водородные связи между наиболее гидрофильными аминокислотами (полярные связи). ).
Кроме того, многие глобулярные белки, особенно крупные, имеют разные «доли» или «домены», которые могут выполнять разные функции в одной и той же молекуле.
Аналогичным образом, некоторые глобулярные белки встречаются в природе в виде больших белковых комплексов, которые состоят из дискретных (отдельных) полипептидных цепей, также известных как подразделения, поэтому говорят, что они являются белками с четвертичной структурой.
Классификация белков
Белки классифицируются по:
- химической структуре;
- биологической функции;
- месту возникновения.
По своему химическому строению белки делятся на простые и сложные. Простые белки состоят только из аминокислот, в то время как сложные белки, помимо аминокислот, также содержат небелковые соединения, так называемые простетические группы (остаток фосфорной кислоты, нуклеиновые кислоты, гем, атом тяжелых металлов, углеводы, липиды). К ним относятся фосфопротеины, нуклеопротеины, хромопротеины, металлопротеины, гликопротеины и липопротеины.
Классификация белков
Из-за различных функций отдельных белков их можно разделить на:
- структурные белки – коллаген, эластин, кератин, гликопротеины;
- ферментные белки – ферменты;
- защитные белки – иммуноглобулины, фибриноген, интерферон;
- транспортные белки – гемоглобин, альбумин плазмы, липопротеин, трансферрин;
- белки, участвующие в сокращении – актин, миозин;
- гормоны – инсулин, глюкагон, паратиреоидный гормон, кальцитонин;
- белки клеточной мембраны.
По месту нахождения в пище белки можно разделить на:
- животные белки, полученные из мяса, мясного ассорти, птицы, рыбы, молока, сыра, яиц;
- растительные белки, полученные из зерновых продуктов, семян бобовых, картофеля, овощей и фруктов.
Содержание белка в мясе может колебаться в пределах 11-23% (например, свинина – 15-21%, говядина – 16-21%, субпродукты – 11-17%, птица – 18-23%, рыба – 16-19%. ). Растительные продукты содержат в среднем 1-2% белка (исключение составляют: зеленый горошек – 6% белка, брюссельская капуста – 5% белка, а горох, фасоль, чечевица и соевые бобы – 21-25% белка), а зерновые продукты – 7-14. % белков.
Источники белков в продуктах
Глобулярные и волокнистые белки
Белковые ученые традиционно классифицируют белки по многим параметрам, но одним из самых важных является структура. Таким образом, в зависимости от принятой ими трехмерной структуры белки могут быть волокнистыми или глобулярными.
Волокнистые белки — это белки, которые имеют удлиненный вид, поскольку их пептидные цепи обычно параллельны друг другу. Эти белки выполняют множество функций, но наиболее важные из них связаны с клеточной структурой, поддержкой и биомеханикой.
Два классических примера волокнистых белков в организме человека и других животных: кератин и коллаген, которые участвуют в образовании волос и ногтей (первые) и кожи, костей и сухожилий (последние).
С другой стороны, глобулярные белки — это белки, которые имеют довольно округлую или сферическую трехмерную конформацию, поэтому они могут казаться немного более компактными и нерегулярными. Эти белки не участвуют напрямую в клеточной структуре, но они играют фундаментальную функциональную роль.
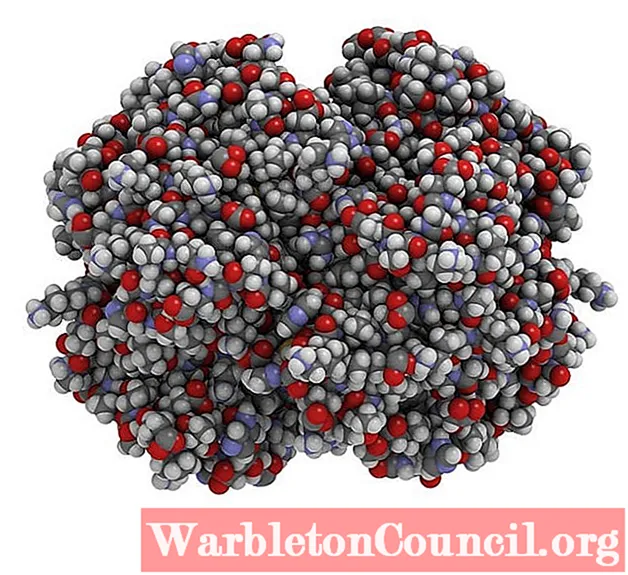
Примерами глобулярных белков являются белки с ферментативной активностью (ферменты), такие как гемоглобин, который участвует в транспортировке кислорода через кровь, и иммуноглобулины, которые работают на иммунную систему млекопитающих.
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
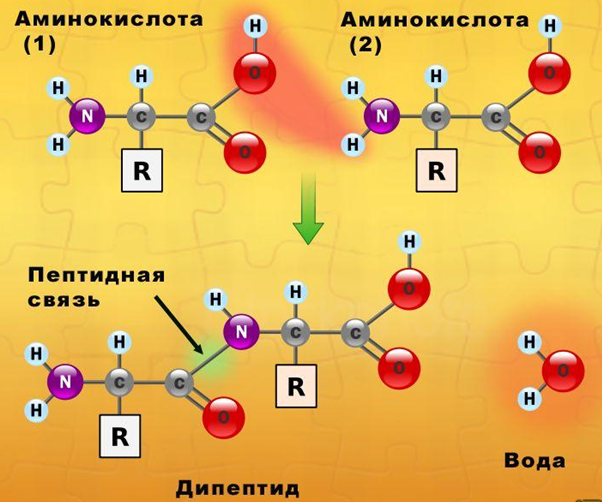
Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
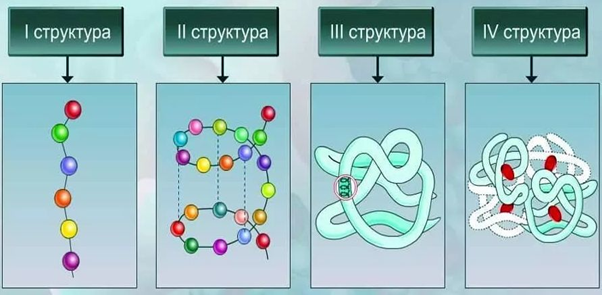
Рис. 2. Структурная организация белков.
Пищевая ценность белков животного и растительного происхождения
В зависимости от пищевой ценности различают:
- полноценные белки;
- частично дефектные белки;
- дефектные белки.
Полноценные белки
Полноценные белки включают те, которые содержат все необходимые (экзогенные) аминокислоты в пропорциях, обеспечивающих их максимальное использование для синтеза белков собственного тела для роста молодых организмов и поддержания баланса азота у взрослых.
Это белки животного происхождения, такие как:
- молоко и продукты из него;
- мясо животных и продукты из них;
- рыба;
- птица и яйца (кроме желатина и фибрина – белков, бедных триптофаном).
Белки животного происхождения
Частично дефектные белки
Частично дефектные белки – это те, которые могут даже содержать все незаменимые аминокислоты, но некоторые из них находятся в недостаточном количестве, и поэтому их достаточно для поддержания жизни, но не для роста организма. Например, зерновые белки со слишком низким содержанием лизина.
Дефектные белки
Большинство растительных белков менее питательны, поскольку содержат меньше лизина, триптофана, метионина и валина. Дефектные белки растительного происхождения, содержат очень мало незаменимых аминокислот или вообще не содержат хотя бы одну незаменимую аминокислоту, не полностью используются для синтеза белков организма и не обеспечивают оптимальный рост молодых организмов или поддержание азотистого баланса у взрослых, часто даже не достаточного для поддержания жизни (например, желатин).
Только белок соевых бобов и других бобовых, а также орехов имеет относительно высокую пищевую ценность, но они не могут заменить 100% полезного животного белка, например, молочного белка. Однако степень биологической ценности растительных белков очень разнообразна. Биологическая ценность диетического белка измеряется содержанием в нем экзогенной аминокислоты, которое является самым низким; содержание этой аминокислоты определяет правильный синтез белка в организме.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
-
Основные различия — это структура и размер. Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
-
Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
-
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Роль белков в организме человека
Белки в организме играют очень важную и незаменимую роль.
- Они используются для построения новых и восстановления изношенных клеток и тканей (без их участия рост, развитие организма, обновление тканей, устойчивость к заболеваниям, заживление ран невозможны).
- Являются основным компонентом крови, лимфы и молока.
- Являются частью иммунных тел, ферментов, катализирующих биохимические изменения, и жидкостей организма.
- Участвуют в регулировании артериального давления и поддержании кислотно-щелочного баланса.
- Действуют как переносчики некоторых витаминов и минералов.
- Сжигаясь, они снабжают организм энергией (1 г белка = 4 ккал).
3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная |
локальное упорядочивание фрагмента полипептидной цепи в спирали
третичная
пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити)
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.






























