Эссенциальная тромбоцитемия
Эссенциальная тромбоцитемия (ЭТ) – это разновидность МПЗ. При этом заболевании в костном мозге вырабатывается слишком много тромбоцитов. Повышенное количество тромбоцитов может привести к образованию тромба — кровяного сгустка, формирующегося в просвете сосуда. Тромб может стать причиной тяжелого заболевания, в том числе инсульта, инфаркта миокарда или легочной эмболии. Другие названия ЭТ – первичная тромбоцитемия, идиопатическая тромбоцитемия и первичный тромбоцитоз. У пациентов с ЭТ ожидаемая продолжительность жизни в среднем не отличается от обычной, если они находятся под медицинским наблюдением гематолога и получают надлежащее лечение.
Лечение хронического миелолейкоза
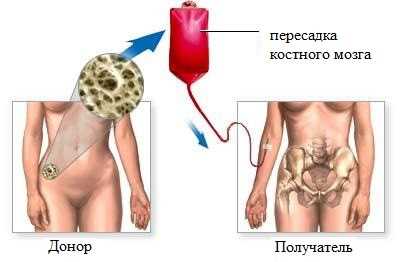
Трансплантация костного мозга даёт реальный шанс на выздоровление пациентам с хроническим миелолейкозом.
Такой вариант лечения складывается из нескольких последовательных этапов.
Поиск донора костного мозга. Наиболее подходящим донором для трансплантации являются близкие родственники. Если среди них не обнаружен подходящий кандидат, необходимо искать такого человека в специальных банках доноров.
После того, как он найден, проводятся различные тесты на совместимость, чтобы убедиться в том, что донорский материал не будет восприниматься организмом пациента агрессивно.
Подготовка пациента к операции продолжается 1-1,5 недели. В это время пациенту проводят химио- и лучевую терапию.
Пересадка костного мозга.
Во время процедуры в вену пациента вводят катетер, по которому в кровоток поступают стволовые клетки. Они оседают в костном мозге и через некоторое время начинают там работать. Для профилактики основного осложнения – отторжения – назначаются назначают лекарственные средства, призванные подавить иммунитет и не допустить воспаления.
Снижение иммунитета. От момента введения стволовых клеток до начала их работы в организме пациента, как правило, проходит около месяца. В это время под воздействием специальных препаратов у пациента снижен иммунитет, это необходимо для профилактики отторжения. Однако, с другой стороны, это создает большой риск инфицирования. Этот период пациент должен провести в стационаре, в специальной палате – его ограждают от контакта с возможной инфекцией. Назначаются противогрибковые и антибактериальные средства, ведется постоянный мониторинг температуры тела.
Приживление клеток.
Самочувствие пациента постепенно начинает улучшаться и приходить в норму.
Восстановление функции костного мозга занимает несколько месяцев. Весь этот период пациент находится под наблюдением доктора.
Рекомендуется противовирусная профилактика и ряд прививок, чтобы защитить организм с ослабленным иммунитетом от инфекций.
Химиотерапия
При хроническом миелолейкозе используется несколько групп лекарственных препаратов:
Препараты гидроксимочевины, тормозяшие синтез ДНК в опухолевых клетках. Среди побочных эффектов могут наблюдаться нарушения пищеварения и аллергия.
Из современных препаратов часто назначают ингибиторы протеинтирозинкиназы. Эти препараты тормозят рост патологических клеток, стимулируют их гибель, и могут быть использованы на любой стадии заболевания. Среди побочных эффектов могут наблюдаться судороги, боли в мышцах, диарея, тошнота.
Интерферон назначается после нормализации количества лейкоцитов в крови для подавления образования и роста и восстановления собственного иммунитета пациента.
Среди возможных побочных эффектов можно выделить депрессию, смену настроения, похудение, аутоиммунные патологии и неврозы.
Лучевая терапия
Лучевая терапия при хроническом миелолейкозе проводится при отсутствии эффекта от химиотерапии или в рамках подготовки к пересадке костного мозга.
Гамма-облучение селезенки помогает затормозить рост опухоли.
Удаление селезенки
В редких случаях может быть назначено удаление селезенки или, говоря медицинским языком, спленэктомия. Показаниями для этого служат резкое снижение тромбоцитов или сильные боли в животе, значительное увеличение органа или угроза его разрыва.
Лейкоцитофорез
Значительное повышение лейкоцитов может приводить к возникновению серьезных осложнений, таких, как микротромбозы и отек сетчатки. Для того, чтобы их предотвратить, врач может назначить лейкоцитофорез.
Эта процедура схожа с обычной очисткой крови, только в данном случае из нее удаляются опухолевые клетки. Это улучшает состояние пациента и профилактирует осложнения. Лейкоцитофорез также может быть использован в сочетании с химиотерапией для улучшения эффекта от лечения.
Лечение ЭТ
Основная цель лечения пациентов с ЭТ состоит в предупреждении образования тромбов и кровотечений. Гематолог может назначить специфическое лечение по поводу ЭТ. У пациентов из категории низкого риска, у которых отсутствуют симптомы, риск осложнений может быть низким. Врач может назначить аспирин в низкой дозе или вообще не назначить никаких лекарств. Врач должен тщательно следить за состоянием здоровья пациента путем регулярных осмотров, отслеживая любые признаки прогрессирования болезни. Пациентам из категории высокого риска врачи могут назначать низкие дозы аспирина для профилактики тромбозов в сочетании с другими препаратами для уменьшения количества тромбоцитов.
Медикаментозная терапия. Для лечения ЭТ может назначаться любой из перечисленных ниже препаратов, как в качестве монотерапии, так и в комбинациях. Очень высокое количество тромбоцитов. У молодых пациентов из категории низкого риска тромбообразования но с чрезвычайно высоким количеством тромбоцитов (более 2 млн тромбоцитов в микролитре крови) повышен риск кровотечений. В этом случае следует рассмотреть необходимость применения препаратов для снижения количества тромбоцитов. Однако таким пациентам нельзя назначать аспирин, по меньшей мере, до снижения количества тромбоцитов, поскольку он может способствовать возникновению кровотечений.
Миелофиброз
Миелофиброз (МФ) – это редкое заболевание, при котором в костном мозге появляются патологические клетки крови и фиброзные волокна. В костном мозге содержатся незрелые стволовые клетки, также называемые гемопоэтическими стволовыми клетками, которые могут превращаться в любые основные клеточные элементы крови: эритроциты, лейкоциты или тромбоциты. Первичный МФ начинается с появления одной или нескольких мутаций в ДНК одной единственной гемопоэтической стволовой клетки. Мутантная стволовая клетка неконтролируемо делится, копируя свою ДНК, в результате чего образуется множество патологических незрелых клеток крови, которые называются бластами. Эти бласты не созревают до здоровых клеток крови и не способны выполнять функции здоровых клеток крови. Сеть фиброзных волокон в костном мозге утолщается и становится похожей на рубцовую ткань. При миелофиброзе в костном мозге образуется много патологически измененных мегакариоцитов. Эти мегакариоциты высвобождают вещества, которые называются цитокинами. Некоторые исследователи полагают, что эти вещества вызывают воспалительные реакции и стимулируют разрастание фиброзной ткани в костном мозге. Постепенное замещение костного мозга фиброзной тканью со временем начинает препятствовать выработке здоровых клеток крови. В результате в костном мозге образуется все меньше здоровых клеток крови. Если костный мозг перестает вырабатывать достаточное количество неизмененных эритроцитов, то у пациента возникает анемия.
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).
В КМ – аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов – клеток-родоначальниц гранулоцитарного ряда.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного – до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Лечение
Онкогематологи назначают лечение своим больным по результатам диагностических исследований. Существуют стандартные терапевтические методики, которые применяют при различных видах МПЗ. Если у пациента обнаружена начальная стадия процесса, когда еще отсутствуют клинические признаки, за ним устанавливают динамическое наблюдение. При появлении первых признаков патологии переходят непосредственно к лечению.

Каждому больному подбирается индивидуальная лечебная методика в соответствии с его состоянием и степенью выраженности имеющихся нарушений.
- Флеботомия — регулярный забор венозной крови у больного, позволяющий уменьшить содержание эритроцитов в кровяном русле. Отобранный материал в объеме 400-500 мл направляется в лабораторию для проведения общеклинического и биохимического исследований.
- Аферез тромбоцитов — методика, направленная на очищение крови от избытка тромбоцитарных элементов. Для этого применяют специальное оборудование — сепаратор, через который пропускают кровь больного, а затем, после очищения, вводят ему обратно.
- Гемотрансфузионное лечение — обычное переливание крови, в ходе которого атипичные клетки замещаются здоровыми, донорскими.
- Иммуномодулирующая терапия — введение больному лекарственных средств, усиливающих функциональную активность иммунокомпетентных клеток и стимулирующих иммунную систему в целом. Эти препараты применяются для того, чтобы организм самостоятельно боролся с недугом.
- Химиотерапия — использование цитостатиков, которые являются классическими и общепринятыми средствами для борьбы с раковыми клетками. Противоопухолевые препараты препятствуют росту и развитию новообразований. Применять их можно системно и регионально. В первом случае лекарство вводят парентерально, перорально или внутримышечно. Активные компоненты цитостатиков проникают в системный кровоток и уничтожают атипичные клетки. При региональном применении лекарство воздействует непосредственно на очаг поражения. Инъекцию делают в спинной мозг или патологически измененный орган.
- Лицам с пораженной и увеличенной селезенкой показана лучевая терапия, основанная на применении высокочастотного излучения, например, рентгеновского. Это очень эффективная методика, позволяющая полностью освободить орган от опухолевых структур. Внешняя лучевая терапия — ионизирующее излучение на область селезенки от препарата, расположенного рядом с больным, внутренняя — введение радиоактивного вещества в ткани, окружающие пораженный орган.
- Существуют и иные, менее эффективные методы консервативного лечения — применение медикаментозных средств «Леналидомида», «Талидомида», которые препятствуют образованию в опухоли костного мозга новых кровеносных сосудов.
- Хирургическое вмешательство — спленэктомия. Селезенку удаляют, когда она значительно увеличена.
- Больные могут по желанию испробовать на себе новые методы лечения, которые находятся на стадии клинических испытаний. Зачастую такая терапия дает хорошие результаты и приводит в отдельных случаях к длительной ремиссии.
- Трансплантация костного мозга — единственный метод, который может полностью вылечить больного. Клеточная трансплантация представляет собой замещение атипичных клеток полноценными, которые берут у самого больного или донора. Клеточные элементы замораживают, а после химиотерапевтического лечения внедряют в организм. Данная процедура очень тяжело переносится больными, особенно лицами пожилого возраста с целым рядом сопутствующих заболеваний. Им гематологи назначают комплексную противоопухолевую терапию, которая позволяет добиться стойкой ремиссии.
трасплантация КМ – наиболее радикальная, но и потенциально действенная методика при удачном исходе
После проведения полного лечебного курса наступает период реабилитации. Больной должен находится под постоянным наблюдением доктора и строго выполнять все его предписания, позволяющие организму быстрее восстановиться.
Пациентам рекомендовано:
- правильное, сбалансированное питание с ограничением жирных, соленых, острых блюд и полным исключением алкоголя, курения;
- долгие пешие прогулки на свежем воздухе, желательно около водоема;
- исключение чрезмерного физического перенапряжения;
- соблюдение режима дня – полноценный сон, чередование труда и отдыха.
Миелопролиферативное заболевание — рецидивирующий процесс, способный обостриться в любое время. Именно поэтому всем пациентам необходимо регулярно посещать лечащего врача и проходить диагностические исследования с профилактической целью.
Диагностика хронического миелоидного лейкоза
Заболевание часто обнаруживается случайно, когда человек сдает анализы для выявления причин не связанных с ним проблем со здоровьем или во время плановой диспансеризации. Если у специалистов появляется повод подозревать наличие лейкоза, они назначают дополнительные исследования:
Общий анализ: измерение количества различных клеток крови – переносящих кислород эритроцитов, противостоящих инфекциям лейкоцитов и останавливающих кровотечения тромбоцитов. Кроме того, с его помощью определяют процент измененных клеток, не способных выполнять свои задачи.
Анализ костного мозга – важная составляющая процедуры диагностики, поскольку именно в этом органе начинает развиваться лейкоз. Его образцы получают в ходе 2 процедур, которые обычно назначаются одновременно:
- Для выполнения аспирации человек ложится на бок или на живот, врач очищает и обезболивает кожу в области бедра, после чего вводит тонкую полую иглу в кость и отсасывает ее жидкое содержимое.
- Как правило, затем проводится биопсия – изъятие небольшого кусочка кости и костного мозга с помощью специального инструмента.
Затем специалисты подсчитывают количество кроветворных клеток в материалах. У людей с миелолейкозом их часто оказывается много, поскольку в них содержится большое количество лейкозных клеток.
Кроме того, эти вмешательства необходимы и после постановки диагноза – с помощью их данных оценивается эффективность проводимой терапии.
Биохимический анализ крови: выявляет в ней различные химические вещества и проблемы с печенью или почками, вызванные распространением измененных клеток и побочными эффектами лекарств. Помогает понять, необходим ли человеку прием различных препаратов для корректировки уровней минералов в крови.
Генетические тесты: обнаруживают измененные хромосомы и лейкозный ген BCR-ABL. Используются для подтверждения диагноза и получения дополнительной информации о неправильных клетках.
Компьютерная томография, КТ – создание множества рентгеновских снимков, которые объединяются в одно подробное изображение. Помогает обнаруживать укрупненные лимфатические узлы – «фильтры» организма, задерживающие и обезвреживающие опасные вещества. Назначается при подозрении на поражение селезенки. Кроме того, дает врачам возможность четко направлять иглу при биопсии – взятии образцов тканей.
Магнитно-резонансная томография, МРТ – позволяет изучать состояние мягких внутренних тканей. Особенно эффективна при исследовании головного и спинного мозга.
УЗИ можно использовать для осмотра лимфатических узлов, которые расположены рядом с поверхностью тела, или для выявления увеличенных органов, таких как почки, печень и селезенка.
В онкологическом центре «Лапино-2» выполняется полная диагностика хронического миелоидного лейкоза.
Мы проводим все возможные исследования, берем анализы и быстро получаем их результаты из собственной лаборатории.
Пациентам, которые наблюдаются или проходят лечение в других клиниках, мы предлагаем услугу второго мнения – консультацию опытного врача любой специальности. Наши доктора помогут вам убедиться в правильности имеющихся заключений или выявить в них неточности.
Лечение МФ
Для лечения первичного МФ применяются те же методы, что и для лечения вторичных форм этого заболевания (постполицитемического и посттромбоцитемического МФ). Однако не существует единого метода лечения, одинаково эффективного для всех пациентов с МФ. У пациентов с МФ могут быть разные клинические проявления и обстоятельства, требующие применения разных методов лечения. У некоторых пациентов с МФ в течение многих лет болезнь течет бессимптомно и не требует немедленного лечения. Тем не менее, все пациенты с МФ должны находиться под тщательным медицинским наблюдением у специалистов. Лекарства, способного излечить МФ, не существует. Единственный метод лечения, потенциально способный излечить пациента от МФ – это аллогенная трансплантация стволовых клеток. Однако эту процедуру рискованно проводить пожилым пациентам и пациентам, имеющим сопутствующие заболевания. Поскольку МФ в основном болеют люди пожилого возраста, трансплантация стволовых клеток как метод лечения не показана большинству пациентов с МФ. Лечение МФ у большинства пациентов направлено на устранение симптомов болезни и предупреждение осложнений, продление срока жизни и повышение ее качества.
Частные симптомы и диагностика
Клинические проявления и степень их выраженности по причине многообразия форм МДС позволяют себе широкие вариации. Случайной находкой синдром выступает редко (это бывает, если человек неплохо себя чувствует, а анализы назначаются в силу других обстоятельств). В основном же, больные направляются в поликлинику с определенными жалобами (постоянное ощущение усталости, одышка, физическая слабость, головокружения, частые подъемы температуры тела), где после тестирования крови становятся очевидными и другие признаки миелодиспластического синдрома:
- Цитопения (снижение количества полноценных форменных элементов крови);
- Анемия (низкий гемоглобин, мало эритроцитов), которая и определяет симптомы, заставившие пойти к врачу;
- Нейтропения (недостаточное содержание в крови нейтрофильных лейкоцитов, обладающих способностью поглощать бактериальные клетки в очаге воспаления – она становится причиной частых инфекций и лихорадки);
- Тромбоцитопения (уменьшение численности тромбоцитов, что обуславливает появление геморрагического синдрома – кровотечений, мелкоточечных подкожных кровоизлияний, синяков).
Между тем, отдельные пациенты относительно долго могут жить и не подозревать, что здоровье «пошатнулось». И тогда МДС становится случайной находкой уже на стадии проведения общего анализа крови.
Чаще всего поводом все же обратиться в поликлинику служат жалобы больного, которые в наибольшей степени связаны с анемией. Пробовать повысить уровень красного пигмента крови (Hb) и содержание красных кровяных телец (Er) препаратами железа и витаминами бесполезно, лечение успехов не приносит, ведь анемия при МДС – рефрактерная. При подозрении на МДС, которое возникает в ходе проведения общего анализа крови (ОАК), добавляются другие исследования:
- Подсчет молодых форм красного ростка, которым уже «позволено» присутствовать в циркулирующей крови – ретикулоцитов, они «подскажут», насколько быстро идет процесс воспроизводства новых зрелых кровяных телец;
- Цитологическое исследование аспирата КМ (у пожилых пациентов данный тест не принадлежит к обязательным анализам);
-
трепанбиопсия костного мозга
Трепанобиопсия (процедура обязательна для всех больных) – после изучения морфологических особенностей гистологический анализ развеет сомнения или подтвердит подозрения;
- Цитогенетический тест (поскольку МДС зачастую связан с хромосомными дефектами), который находит аномальный клон (если он есть на самом деле) и подтверждает его вмешательство в процесс кроветворения, в противном случае – картину МДС может давать какое-то реактивное состояние.
Безусловно, диагностика миелодиспластического синдрома, начинается с жалоб больного и ОАК, но в дальнейшем опирается на более сложные лабораторные исследования. Здесь врачу есть над чем подумать, чтобы правильно оценить нарушения кроветворения, ведь изменения клеточного состава и морфологических особенностей клеток крови и костного мозга могут быть весьма многочисленны и многообразны. Впрочем, как и сама болезнь…
костный мозг при МДС
Симптомы хронического миелолейкоза
Проявления заболевания напрямую зависят от стадии.
Симптомы хронической стадии:
В большинстве случаев протекает бессимптомно. Некоторые пациенты жалуются на слабость, повышенную утомляемость, но, как правило, не придают этому значение. На данном этапе заболевание выявляется при очередном анализе крови.
В некоторых случаях может наблюдаться снижение веса, потеря аппетита, повышенная потливость, особенно во время ночного сна.
При увеличении селезенки могут возникать боли в левой половине живота, особенно после еды.
В редких случаях развивается склонность к кровотечениям из-за снижения уровня тромбоцитов. Или, напротив, при их повышении образуются тромбы, что чревато инфарктом миокарда, инсультом, нарушениями зрения и дыхания, головными болями.
Симптомы акселеративной стадии:
Как правило, именно на этой стадии ощущаются первые проявления заболевания. Пациенты предъявляют жалобы на плохое самочувствие, резкую слабость, повышенную потливость и боли в суставах и костях. Беспокоит повышение температуры тела, повышенная кровоточивость и увеличение живота из-за роста опухолевой ткани в селезенке.
Разновидности
К ХМПЗ можно отнести несколько видов онкозаболеваний.
1. Эозинофильный лейкоз.
При болезни в крови и костном мозге обнаруживается большое количество клеток предшественников эозинофилов. Это один из видов лейкоцитов, который является «первым эшелоном» в борьбе с инфекцией. Эозинофилы покидают сосуды и передвигаются к месту воспаления. Там они активизируют на окружающих клетках рецепторы, воспринимающие иммуноглобулины IgE, которые вырабатываются В-лимфоцитами. В результате эти клетки разрушаются и помещают патоген в своеобразную капсулу, которая затем поглощается макрофагами.
Однако повышенное привлечение иммуноглобулинов приводит к формированию аллергической реакции, появлению инфильтратов, отеков. При лейкозе они становятся очень выраженными. Весь организм как бы попадает в воспалительный процесс. Наблюдается диарея, множественные отеки, язвы, инфильтраты в легких, сердечная недостаточность. Болят мышцы, суставы.
2. Нейтрофильный лейкоз.
Это вид заболевания, при котором в крови повышается количество здоровых зрелых нейтрофилов. В костном мозге аномального роста клеток-предшественников нет. Появляется избыток из-за аномальных стволовых клеток, которые способны дифференцироваться только в гранулоциты.
Нейтрофилы относятся к лейкоцитам, которые участвуют в создании иммунной защиты. В их цитоплазме есть гранулы, заполненные разными ферментами, способными переваривать клеточные оболочки, соединительные ткани и другие компоненты. При попадании в организм инфекции нейтрофилы покидают кровеносное русло, идут в ткани, поглощают и переваривают патогены. После захватывания чужеродного элемента нейтрофил тоже погибает.
Избыточное количество нейтрофилов приводит к повреждению здоровых тканей организма.
3. Эссенциальную тромбоцитемию.
Происходит увеличение количества всех клеток крови, но больше всего тромбоцитов. Эти форменные элементы отвечают за свертываемость крови. Они способны объединяться, формируя пробку, закрывающую разрыв сосуда, а также выделять вещества, ускоряющие рост и заживление сосудистых тканей. Даже при отсутствии ранений тромбоциты подпитывают артерии и вены, укрепляют их.
Однако избыточное количество этих телец приводит к закупорке сосудистого русла, эмболии, инсультам и инфарктам. Иногда повышение числа тромбоцитов сопровождается существенным снижением выработки белка, который провоцирует прикрепление тромбоцитов к поверхности артерии. Из-за этого начинаются кровотечения.
4. Истинную полицитемию.
Для этой болезни характерен избыточный рост и деление клеток костного мозга. Затрагивает в основном клетки, которые дифференцируются в эритроциты. В анализе крови определяется их избыточное количество.
Эритроциты содержат гемоглобин, который переносит кислород ко всем тканям организма. Поэтому обычно в анализе в первую очередь смотрят, чтобы не было анемии – сниженного количества гемоглобина. Однако повышение уровня эритроцитов не менее опасно. Оно приводит к увеличению вязкости крови и формированию тромбов. Часто случаются инфаркты и инсульты. Несмотря на избыток эритроцитов из-за вязкости они не могут выполнять свои функции и периферическим тканям не хватает кровоснабжения и питания. Поэтому конечности у таких людей всегда холодные, кожа часто бледная, беспокоят головные боли, плохо заживают раны.
5. Идиопатический миелофиброз.
При этом заболевании участки костного мозга подвергаются замене на фиброзную ткань, поэтому не могут выполнять свои функции. Вместо этого образуются очаги аномального кроветворения в областях, прилегающих к мозгу. При этом производится избыточное количество моноцитов и макрофагов.
Обе разновидности клеток являются своеобразными «уборщиками» в организме, так как поглощают и перерабатывают чужеродные объекты. Они способны покидать кровеносное русло, выходить в ткани и там уничтожать вирусы, бактерии, отдельные белки.
Одновременно с этим они вырабатывают различные вещества для защиты организма. Сюда относятся цитотоксины (соединения, вызывающие гибель чужеродных клеток), интерфероны (вещества, которые защищают ткани от проникновения в них вирусов), а также ростовые факторы и факторы свертывания крови. Эти белки повышают рост соединительной ткани, помогают остановить кровотечения и обеспечивают защиту в местах ранений.
Однако при идиопатическом миелофиброзе моноцитов становится слишком много и выделяемые ими вещества начинают вредить организму. Появляются очаги фиброза в органах, растут новые ненужные сосуды, формируются опухоли, образовываются тромбы.
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В клинике «Евроонко» лечение миелолейкоза соответствует всем современным лечебным протоколам
В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Лечатся все по-разному
Следует сразу настроить пациента, что лечение МДС не будет одинаковым для всех его разновидностей. Набор терапевтических мероприятий рассматривается в индивидуальном порядке, исходя из формы болезни и категории риска, которой принадлежит пациент (согласно клинической классификации Международной Прогностической Системы – IPSS для МДС: низкий, промежуточный 1 и 2, высокий). Словом, существуют определенные каноны, которых доктор придерживается, прежде чем приступить к непосредственному лечению. К примеру:
- Люди, не перешагнувшие 60-летний рубеж, имеющие минимальные признаки болезни, но отнесенные к категории промежуточного или высокого риска с ожидаемой выживаемостью 0,3 – 1,8 года, подвергаются высокоинтенсивной терапии;
- Пациенты, принадлежащие к группе промежуточного и низкого риска с ожидаемой выживаемостью 5-12 лет, проходят лечение низкой интенсивности;
- Молодые люди и больные среднего возраста (до 60 лет) с относительно неплохими показателями (ожидаемая выживаемость от полугода до 5 лет) первоначально лечатся по схемам низкой интенсивности, хотя в любой момент им грозит оказаться в группе, получающей более жесткое лечение (высокие дозы химиотерапии, пересадка КМ).
Таким образом, схемы лечения миелодиспластического синдрома довольно сложны и знает их только врач, получивший в свое время определенную специализацию (гематолог). Он в своей лечебной тактике опирается на рекомендации, разработанные Британским комитетом по стандартизации в гематологии (редакция 2009 года). Читателю же, на наш взгляд, достаточно познакомиться с основными методами проведения терапевтических мероприятий, особо не вникая в тонкости, не ставя диагноз и не причисляя себя или своих близких к той или иной группе риска. И еще, наверное, не помешает знать, что:
- Лечение высокой интенсивности – это, во-первых, обязательное пребывание в специализированном стационаре, во-вторых, назначение высоких доз химиотерапии и, возможно, подготовка к пересадке стволовых клеток и сама пересадка;
- Низкоинтенсивная терапия подразумевает пребывание в больнице (или даже в условиях дневного стационара) время от времени для получения заместительной терапии, низких доз химиопрепаратов, симптоматического лечения.
К сожалению, способа избавиться от такого тяжелого недуга, как МДС, раз и навсегда, пока не придумали. Разве что пересадка главного кроветворного органа (костного мозга) могла бы решить проблему, однако она тоже сопряжена с определенными трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора по всему миру). Правда, в последние годы, как на территории Российской Федерации и ближайшей соседки – Беларуси, так и на территории других государств бывшего СССР, создаются новые лаборатории тканевого типирования, объединяющие свои реестры в единый банк, чтобы иметь возможность помочь друг другу. На них и возлагаются будущие надежды.
Лечение
В случае малосимптомного течения миелофиброза показано динамическое наблюдение. При отсутствии выраженной цитопении, прежде всего анемии, лечение не проводят. При гиперурикемии назначают аллопуринол. При анемии используют анаболические стероиды.
При гемолитическом характере анемии может быть выполнена спленэктомия.
В случае развития выраженных экстрамедуллярных очагов кроветворения, сплено- и гепатомегалии, гипертромбоцитозе показана химеотерапия. Применяют препараты гидроксимочевины с целью уменьшения органомегалии и поддержания показателей крови, близких к норме.
Причины
пример jak2 мутации при истинной полицитемии (избытке эритроцитов)
В основе МПЗ лежит приобретенная генная мутация, обусловленная влиянием негативных внешних или внутренних факторов. Мутация генов MPL и jak 2 приводит к повреждению ДНК одной гемопоэтической клетки, которая дает начало всем типам клеточных элементов. Аномально изменившаяся бластная форма приобретает отрицательные черты — перестает развиваться, не созревает полностью, не самоуничтожается, а непрерывно делится и порождает многочисленные клоны. Именно поэтому МПЗ называют клональным. Клоны также остаются на начальном уровне развития и имеют полностью недифференцированную структуру. Повреждаться может как один, так сразу несколько ростков кроветворения.
Причины, вызвавшие мутационные процессы, остаются до конца неизученными. Одни ученые относят к ним негативные факторы окружающей среды, другие — ошибки при делении клеток. МПЗ не является наследственным. Мутации генов могут возникать на протяжении всей жизни человека. Они называются приобретенными. Риск развития патологии увеличивается с возрастом. Лицам старше 50 лет необходимо внимательно относиться к здоровью и при появлении подозрительной симптоматики обращаться к гематологу. Вероятность развития недуга повышается под воздействием факторов риска — облучения и химикатов, оказывающих токсическое влияние на организм.






























