Вопросы и ответы
Как проявляется патология?
— На ранних стадиях пациент испытывает постоянные боли, которые не зависят от уровня физической активности. Позднее область рядом с очагом патологического процесса опухает, на коже появляется характерная венозная сетка. Происходит разрушение костной ткани, отслоение надкостницы. В запущенных случаях развиваются патологические переломы.
Поддается ли лечению данный тип рака?
— Лечение состоит из трех стадий: предоперационного облучения опухоли, удаления поврежденных тканей и послеоперационного курса химиотерапии.
Какова продолжительность жизни пациентов с раком костей?
— Пятилетняя выживаемость пациентов после комплексного лечения достигает 85%. Ухудшение прогноза возможно при обнаружении у ребенка или взрослого множественных метастазов или рецидива первичной опухоли, которая привела к поражению костных тканей.
Симптомы
Дебют клинических проявлений остеопетроза может произойти в любом возрасте, как у младенцев, так и у пожилых людей. Наиболее часто заболевание проявляется в детском возрасте. Остеопетроз долгие годы может протекать бессимптомно. В основном обнаруживается случайно во время рентгенографии после травмы или по причине другой болезни. Особенности и выраженность симптоматики зависят от генетической формы остеопетроза и времени появления яркой симптоматики. В течение первого года жизни у детей возникает гидроцефалия вследствие разрастания костей основания черепа. Маленькие пациенты поздно начинают ходить, отстают в росте, страдают от расстройств слуха и зрения, нарушения моторики. В более позднем возрасте остеопетроз проявляется болями и утомляемостью при ходьбе. Обычно мраморная болезнь выявляется после переломов при незначительных травмах. Нередко в области перелома кости развивается остеомиелит. Также при остеопетрозе отмечаются деформации костей. В случае гипохромной анемии у пациентов наблюдаются: бледность кожи, слабость, головокружения.
Патогенез
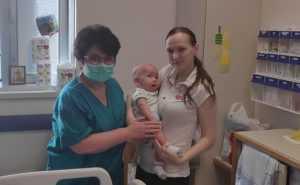
Этому малышу, страдавшему от мраморной болезни, несмотря на карантин сделали успешную ТКМ в клинике Хадасса (2020 г.).Мутации приблизительно в 10 генах вызывают различные типы остеопетроза. Дефекты в гене CLCN7 являются причиной аутосомно-доминантного остеопетроза в 75 % случаев, аутосомно-рецессивного и промежуточного аутосомного остеопетроза в 10-15 % случаев. Мутации гена TCIRG1 — катализатор развития аутосомно-рецессивного остеопетроза у 50 % больных.
Дефекты в других генах являются менее распространенными причинами аутосомно-доминантных и аутосомно-рецессивных форм расстройства. Х-сцепленный тип остеопетроза (OL-EDA-ID) — результат мутаций в гене IKBKG. Примерно в 30% случаев этиология мраморной болезни неизвестна.
Гены, связанные с остеопетрозом, участвуют в формировании, развитии и функционировании клеток остеокластов, которые разрушают старую костную ткань. Чтобы кости оставались крепкими и здоровыми, остеокласты ремодулируют (перестраивают) их. Мутации в любом из генов, связанных с остеопетрозом, приводят к дефектам и недостаточности остеокластов.
Без функциональных остеокластов старая костная ткань не разрушается для формирования новой. В результате, кости становятся очень плотными с аномальной структурой, что делает их склонными к переломам. Нарушения ремоделирования костей лежат в основе главных факторов мраморной болезни.
Классификация

Владислав — один из многих детей с Украины, которых ТКМ в клинике Хадасса избавила от мраморной болезни. На снимке ему 4.5 года. (2012 г.)По международной классификации болезни 10 пересмотра (МКБ-10) мраморной болезни или синдрому Альберс-Шенберга присвоен код Q78.2. Также остеопетроз классифицируют на несколько форм, в зависимости от типа наследования. Мраморная болезнь может передаваться по аутосомно-доминантному, аутосомно-рецессивному, Х-сцепленному механизму наследования.
Аутосомно-доминантный остеопетроз (АДО) является наиболее распространенной формой заболевания, встречаемость которой составляет 1:20000. Аутосомно-рецессивный (злокачественный) остеопетроз (АРО) выявляется реже, примерно у 1 из 250 000 человек. Другие формы мраморной болезни (OL-EDA-ID и IAO) обнаруживаются крайне редко. Признаки варьируются в зависимости от наследственной формы остеопетроза.
Аутосомно-доминантный остеопетроз (АДО) является легким видом заболевания, поскольку отличается длительным отсутствием специфических и тяжелых признаков. Данную форму остеопетроза обычно обнаруживают случайно на рентгене, сделанном при диагностике другой болезни. Первые признаки АДО преимущественно возникают после 10-14 лет. У пациентов с аутосомно-доминантным остеопетрозом наблюдаются частые переломы костей, остеомиелит, сколиоз и другие аномалии позвоночника.
Аутосомно-рецессивный остеопетроз (АРО) проявляется в раннем детстве и является более тяжелой формой заболевания. У детей регулярно возникают переломы даже от слабых ударов и падений, отмечается медленный рост, аномалии зубов, гепатоспленомегалия. В зависимости от генетических изменений могут быть неврологические нарушения, которые сопровождаются умственной отсталостью или систематическими приступами эпилепсии. При аутосомно-рецессивной форме остеопетроза плотные кости черепа нарушать работу мозга и сдавливают черепные нервы, что приводит к потере слуха и зрения, параличу лицевых мышц, снижению концентрации гемоглобина и количеству эритроцитов (гипопластической анемии), а также рецидивирующим инфекциям. В младенчестве или раннем детстве подобные тяжелые нарушения могут привести к гибели ребенка.
В случае промежуточного аутосомного остеопетроза (IAO), сочетающего аутосомно-доминантный или аутосомно-рецессивный тип наследования, симптомы манифестируют в детстве. Основные признаки: повышенный риск переломов костей, ацидоз почечных канальцев, аномальные отложения кальция (кальцификации) в головном мозге, анемия, умственная отсталость.
При Х-сцепленном типе наследования, остеопетроз характеризуется не только уплотнением костей. Патология сопровождается иммунодефицитом, лимфодемой, вызванной скоплением жидкости в лимфатических путях, а также ангидротической эктодермальной дисплазией, которая поражает кожу, волосы, зубы и потовые железы.
Прогноз и профилактика рака костного мозга
Прогноз при раке костного мозга определяется видом опухоли. Например, при острых лейкозах пятилетняя безрецидивная выживаемость колеблется в пределах 80%. При этом, чем больше времени прошло от начала ремиссии, тем вероятнее, что болезнь отступила полностью. Но в любой момент может развиться рецидив — возврат заболевания, который потребует повторного лечения. У некоторых больных таких рецидивов может быть несколько, при этом с каждым разом добиться ремиссии сложнее, но это не значит, что невозможно. У ряда пациентов даже после нескольких рецидивов можно добиться выздоровления.
Что касается хронических лейкозов, то они очень сложно поддаются излечению, но протекают длительное время с периодами обострения и затухания. Учитывая то, что в большинстве случаев они развиваются у людей старшего возраста, радикальное лечение может быть противопоказано ввиду наличия сопутствующей патологии. В этих случаях назначают поддерживающую терапию.
Миелома также относится к неизлечимым патологиям. Даже при успешном ответе на двойную пересадку стволовых клеток вероятность развития рецидива в ближайшие 3-4 года остается очень высокой.
На вопрос о том, сколько живут при раке костного мозга, нельзя дать однозначного ответа, и уж тем более не стоит применять к отдельно взятому пациенту общую статистику. О прогнозе может судить только лечащий врач. Он расскажет, сколько живут с раком костного мозга при конкретном диагнозе, стадии и особенностях течения, какой результат ожидается от лечения.
Методов профилактики рака костного мозга на сегодняшний день нет. Единственное что можно рекомендовать, это защиту от воздействия канцерогенных факторов и по возможности предотвращение развития приобретенных иммунодефицитов. Пациентам, находящимся в группе риска, необходимо не пренебрегать ежегодной диспансеризацией.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Какие пороки развития конечностей видны на УЗИ
Кости малыша видны на ранних сроках беременности – бедренная и плечевая – с 10 недель, кости голеней и предплечья – с 10 недель. В это время уже можно посчитать пальчики, увидеть большинство костей скелета и посмотреть, как ребенок шевелит ручками и ножками. КАк раз в этот период проводят первые скрининги плода.
В 16 недель, как раз с момента второго скрининга, можно измерить длину крупных костей, оценив развитие плода. Учитывают размер и форму конечностей. Небольшая кривизна ножек не является аномалией, но выраженная деформация — признак патологии.
Все остальные части скелета – позвоночник, ребра, черепные кости должны быть правильно развиты и не деформированы.
|
Срок, нед. |
Голень |
Бедро |
Предплечье |
Плечо |
|
11-12 |
— |
5,6-7,3 |
— |
— |
|
13-14 |
— |
9,4-12,4 |
— |
— |
|
15-16 |
15,0-18,0 |
16,3-20,0 |
12,0-15,0 |
15,0-18,0 |
|
17-18 |
21,0-24,0 |
24,0-27,0 |
18,0-20,0 |
21.0-24,0 |
|
19-20 |
27,0-30,0 |
30,0-33,0 |
23,0-26,0 |
27,0-30,0 |
|
21-22 |
33,0-35,0 |
36,0-39,0 |
20,0-30,0 |
30,0-35,0 |
|
23-24 |
38,0-40,0 |
41,0-44,0 |
30,0-35,0 |
38,0-40,0 |
|
25-26 |
44,0-46,0 |
46,0-49,0 |
37,0-39,0 |
43,0-45,0 |
|
27-28 |
47,0-49,0 |
51,0-53,0 |
41,0-43,0 |
47,0-49,0 |
|
29-30 |
51,0-53,0 |
55,0-57,0 |
43,0-44,0 |
49,0-51,0 |
|
31-32 |
55,0-56,0 |
59,0-61,0 |
48,0-49,0 |
55,0 |
|
33-34 |
58,0-60,0 |
63,0-65,0 |
50,0-52,0 |
58,0-59,0 |
|
35-36 |
61,0-63,0 |
67,0-69,0 |
54,0-55,0 |
61,0-62,0 |
|
37-38 |
64,0-65,0 |
71,0-73,0 |
55,0-56,0 |
63,0-64,0 |
|
39-40 |
66,0-67,0 |
74,0-75,0 |
57,0-58,0 |
65,0-66,0 |
Что представляет собой заболевание
Несовершенный остеогенез – редкое генетическое заболевание, имеет несколько названий: «несовершенное костеобразование», болезнь «хрустального человека», внутриутробный рахит, болезнь Лобштейна (Фролика) и другие.
Впервые о заболевании появилась информация в научных трудах XVII в. В конце XVIII в. Olaus Jacob Ekmann в своих работах описал данную патологию у членов одной семьи. N. Ekroth в то же время наблюдал заболевание, которое в четырех семьях передавалось детям, и назвал его osteomalacia congenita
Axmann (1831 г.) описал ломкость костей у себя и брата, а также акцентировал внимание на таком важном симптоме, как голубые склеры
Частота встречаемости патологии – 1 случай на 10-20 тыс. новорожденных. Но нужно учитывать, что при легком течении болезнь часто остается невыявленной из-за слабых клинических признаков, поэтому распространенность может быть намного выше. Несмотря на то, что данная болезнь неизлечима, как и другие генетические болезни, можно значительно облегчить и даже нормализовать жизнь «хрупких детей».
Возраст больных при появлении симптомов варьируется. Люди с легкой степенью патологии могут не иметь патологических переломов в детстве либо же они наблюдались в младенчестве, но их число значительно сократилось к моменту пубертации с дальнейшим обострением. У больных с тяжелыми формами переломы наблюдаются уже во внутриутробном развитии.
Что такое остеопороз
Остеопороз, который буквально означает «пористая кость», является заболеванием, понижающим плотность и качество костной ткани. Поскольку кости становятся менее прочными, риск перелома значительно возрастает. Снижение качества костной ткани происходит незаметно и постепенно. Часто до появления первого перелома нет никаких симптомов.
По мере того, как мы стареем, некоторые из костных клеток рассасываются (резорбция), в то же время при росте новых клеток образуются остеоиды. Этот процесс известен как ремоделирование. Благодаря ему, до сорока лет у здоровых людей костная масса остается постоянной, затем происходит ее ежегодное снижение:
- у мужчин – 0,5-2% за год;
- у женщин – 2-3% за год.
У людей с остеопорозом нарушаются процессы ремоделирования, потеря костной ткани идет быстрее, чем рост новой, поэтому кости становятся похожими на губку с крупными порами, возрастает вероятность переломов.
Во всем мире одна из трех женщин и один из пяти мужчин подвергаются риску остеопоротического перелома. Наиболее распространены травмы бедра, позвоночника и запястья.
Лечение
В подавляющем большинстве случаев так называемый рак костного мозга является системным заболеванием с большим объемом опухолевой массы, распространенной по всему организму. Поэтому для радикального лечения требуется системное воздействие на организм, что достигается с помощью химиотерапии, иммунотерапии и таргетной терапии.
Схема лечения будет определяться видом рака. Например, при лейкозах терапию проводят в несколько стадий:
- Индукция ремиссии. На этом этапе преследуется цель уничтожить как можно больше раковых клеток, поэтому используются мощные многокомпонентные схемы химиотерапии. При этом на организм оказывается токсическое действие с двух сторон — непосредственное воздействие химиотерапевтических препаратов плюс воздействие продуктов распада опухоли.
- Консолидация ремиссии. Индукционные препараты, какими мощными они бы не были, не могут за один курс уничтожить все раковые клетки, потому что часть из них находится в неактивном состоянии и «просыпается» по истечении какого-то времени, давая второе начало опухоли. Чтобы их уничтожить, проводится консолидационная терапия.
- Реиндукция ремиссии. Это повторение курса индукционной терапии с целью максимально полного уничтожения оставшихся раковых клеток.
- Поддерживающая терапия. Это последний этап. Его цель — уничтожение оставшихся злокачественных клеток. Для этого назначаются длительные курсы цитостатических препаратов в низких дозах.
При высокозлокачественных формах рака костного мозга (миеломы, агрессивные формы лейкозов, рецидивы заболевания) проводят мощную высокодозную химиотерапию, которая позволяет преодолеть резистентность опухоли. Однако она оказывает мощный уничтожительный эффект на костный мозг, оставляя больного фактически без кроветворения. Чтобы преодолеть это осложнение, проводят трансплантацию гемопоэтических стволовых клеток, которые в последующем послужат основой для восстановления кроветворения.
Стволовые клетки могут забираться у самого пациента на этапе консолидации ремиссии, или от донора. В последнем случае новый клон лейкоцитов будет оказывать противоопухолевое действие на возможные оставшиеся раковые клетки. Таким образом, лечебный эффект будет усиливаться. Однако аллогенные трансплантации могут приводить к развитию такого грозного осложнения, как реакция трансплантат против хозяина, которая в тяжелых случаях может привести к гибели реципиента.
Аллогенные трансплантации показаны далеко не всем пациентам. Их рекомендуют делать, например, при лечении миеломы. Некоторым таким пациентам показана двойная или тандемная трансплантация, при которой проводится две пересадки стволовых клеток.
Что происходит с костью при остеопорозе?
Кость по своему строению может быть двух видов: компактной и губчатой. Компактная ткань очень плотная, имеет однородную структуру и состоит из расположенных концентрически костных пластинок. Именно компактное вещество покрывает все кости снаружи. Толще всего слой компактного вещества в средней части длинных, так называемых трубчатых костей: это, например, бедренная кость, кости голени (большеберцовая и малоберцовая), плечевая, локтевая, лучевая кость. Наглядно это показано на картинке чуть ниже.
Головки костей, а также плоские и короткие кости имеют очень тонкий слой компактного вещества, под которым находится губчатое костное вещество. Губчатое вещество само по себе имеет пористое строение благодаря тому, что состоит из костных пластинок, располагающихся друг к другу под углом и образующих своеобразные ячейки.
Губчатое вещество здоровой кости имеет хорошо выраженные костные пластинки и небольшие поры. Пластинки губчатой ткани расположены не хаотично, а соответственно тому, в каком направлении кость испытывает наибольшие нагрузки (например, при сокращении мышц).
При остеопорозе костная ткань теряет свою минеральную составляющую, в результате чего костные пластинки истончаются или пропадают вовсе. Это приводит и к уменьшению толщины компактного и разрежению губчатого вещества.
В итоге изменяется не только сама минеральная плотность кости, но и, что немаловажно, строение костной ткани. Пластинки перестают выстраиваться по линиям сжатия-растяжения, что существенно уменьшает устойчивость кости к нагрузкам
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).
В КМ – аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов – клеток-родоначальниц гранулоцитарного ряда.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного – до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Симптомы и признаки миелодиспластического синдрома
Проявления заболевания обычно возникают из-за нехватки различных типов клеток крови:
- Анемия, или дефицит переносящих кислород эритроцитов, приводит к появлению головокружений, слабости, усталости, бледности кожи и одышки – ощущению нехватки воздуха.
- Недостаточное количество нормальных лейкоцитов и их разновидности – нейтрофилов, нарушает работу иммунитета, из-за чего у человека часто развиваются инфекции.
- Тромбоцитопения, или нехватка тромбоцитов, ухудшает свертываемость крови. У таких пациентов развиваются кровотечения, в том числе внутренние.
Кроме того, признаки заболевания могут включать в себя:
- Потерю веса без всяких усилий со стороны пациента.
- Повышенную температуру.
- Боль в костях.
- Потерю аппетита.
Все эти симптомы обычно вызваны другими нарушениями и не имеют никакого отношения к миелодиспластическим синдромам, но любые из них могут говорить о наличии серьезных проблем со здоровьем. Если они не проходят или ухудшаются со временем, нужно обязательно обращаться к врачу.

Кратко о болезни
Несовершенный остеогенез (НО) – это группа генетически обусловленных заболеваний, для которых характерна повышенная ломкость костей вследствие нарушения выработки коллагена.

Расшифруем:
- Группа – означает, что это несколько различных заболеваний, объединенных общими чертами. Сегодня известно не менее 15 генов, изменения которых приводят к разным типам болезни.
- Генетически обусловленных – значит, что причиной болезни стала мутация в генах, возникшая спонтанно или переданная через одного или обоих родителей. При этом исключается влияние других факторов, таких как вредные привычки родителей или болезни матери во время беременности, так что никакой их ответственности за возникновение мутации быть не может. В настоящее время ученые пока не могут предложить безопасного способа внедриться в геном живого человека, что, впрочем, не означает, что больному с НО никак нельзя помочь или что он не сможет вести нормальный образ жизни.
- Повышенная ломкость костей – означает, что, в зависимости от типа болезни, у людей с НО есть риски получить от 10 до 100 переломов в течение всей жизни.
- Нарушение выработки коллагена – значит, что болезнь развивается из-за недостаточности и нарушения структуры белка — строительного материала костей. Никакого отношения к обмену кальция в организме НО не имеет, поэтому бессмысленно лечить его кальцием, равно как и препаратами коллагена, который переваривается в желудке, не успевая дойти до костей.
Несовершенный остеогенез — одна из самых часто встречающихся редких болезней, поражающая одного из 12–15 тысяч новорожденных. Множество больных страдает легкой формой патологии, при которой они о ней даже не подозревают. В зависимости от типа НО, правильности и своевременности назначения лечения, качество жизни может разительно отличаться, от нормального состояния здоровья до тяжелой инвалидности.
Помимо ломкости костей, при НО в разных сочетаниях встречаются и другие признаки: низкорослость, деформация костей, снижение слуха, поражение внутренних органов из-за деформаций скелета или особенностей соединительной ткани (могут страдать легкие, сердечно-сосудистая система, глаза, зубы и пр.). Болезнь не оказывает влияния на продолжительность жизни и репродуктивную функцию.
Диагноз НО ставится клинически на основании симптомов, определяемых при осмотре и расспросе, а подтверждает его генетическое исследование. Косвенно постановке диагноза способствуют обнаруженные на рентгенограммах характерные признаки НО и отсутствие изменений в лабораторных анализах крови.
Среди пациентов с НО часто встречаются люди с высоким уровнем интеллекта, творческим даром и сильным характером — это известные актеры, музыканты, писатели и философы, врачи и историки.
Прогноз и профилактика
При своевременном выявлении и адекватном лечении прогноз в большинстве случаев благоприятный. Исключение составляют злокачественные формы с ранней манифестацией и повреждением костного мозга.
Смертельный исход наступает при нарастающей анемии и общей интоксикации организма с образованием метастатических очагов во внутренних органах и тканях – септикопиемии. Септикопиемия, в свою очередь, развивается на фоне остеомиелита, сопровождающего патологический перелом или инфицирование ротовой полости. Профилактики болезни у взрослых нет.
Единственной превентивной мерой служит перинатальная диагностика, позволяющая определить мраморную болезнь у двухмесячного плода. Следует учитывать также, что наиболее вероятно обнаружить остеопетроз у младенца, имеющего родственников с этой аномалией. Предотвратить нарушение процессов костеобразования невозможно.
Диагностика
Для диагностики рака костного мозга требуется комплексный подход. Первым моментом является сбор анамнеза с оценкой имеющихся жалоб и проведением физикального осмотра. Далее пациент направляется на обследование. Заподозрить миелому можно на основании рентгенограммы костей, лейкозов — по общему анализу крови.
Для подтверждения диагноза опухоли костного мозга требуется морфологическое исследование опухолевого субстрата. С этой целью проводят биопсию или пункцию костного мозга. Помимо этого, проводят дополнительные тесты, направленные на уточнение молекулярно-генетического профиля рака. Это необходимо для определения тактики лечения и выбора оптимального метода химиотерапии.
Мраморная болезнь
Различают две формы мраморной болезни: проявляющуюся в раннем возрасте с резко выраженными симптомами и протекающую без видимых клинических проявлений и диагностируемую лишь при рентгенологическом исследовании. Заболевание характеризуется частичным или полным склерозированием губчатого вещества кости, чаще во всем скелете. В ранней стадии заболевания кости склерозированы лишь в области метафизов трубчатых костей, в периферических участках плоских костей; на остальном протяжении этих костей губчатая структура сохранена. Выявляется неравномерное уплотнение костей черепа. Придаточные полости обычно склерозированы (в большей степени — основная и лобная). Поражение челюстных костей сопровождается нарушением развития и прорезывания зубов. Влияние болезни на зубы выражается в замедлении развития, позднем прорезывании и изменении их строения. Зубы имеют недоразвитые корни, облитерированные полости зуба и каналы. Характерна высокая поражаемость зубов кариозным процессом.
Мраморная болезнь, как правило, проявляется в детском возрасте. Нередки семейные поражения. Симптомами, заставляющими больного обратиться к врачу, являются боли в конечностях, утомляемость при ходьбе. Возможно развитие деформаций и возникновения патологических переломов костей конечностей. При осмотре больного отклонений в физическом развитии не отмечают. При рентгенологическом исследовании обнаруживается, что все кости скелета (трубчатые, ребра, кости таза, основание черепа, тела позвонков) имеют резко уплотненную структуру. Эпифизарные концы костей несколько утолщены и закруглены, метафизы булавовидно утолщены, внешняя форма и размеры костей не изменены. Все кости плотны и совершенно не прозрачны для рентгеновского излучения, костномозговой канал отсутствует, кортикальный слой кости не выделяется. Особенно склерозированы кости основания черепа, таза, тела позвонков. В отдельных случаях в метафизарных отделах длинных трубчатых костей видны поперечные просветления, что придает им мраморный оттенок. Кости становятся менее упругими, ломкими. Патологические переломы — нередкое осложнение мраморной болезни. Чаще других наблюдаются переломы бедренных костей. Благодаря нормальному состоянию надкостницы их заживление происходит в обычные сроки, но в отдельных случаях консолидация замедляется из-за выключения из процесса остеогенеза эндоста, т.к. ткани костномозгового канала склерозированы. Последнее обстоятельство в детском возрасте является причиной развития вторичной анемии гипохромного типа.
Недостаточность гемопоэтической функции костного мозга ведет к компенсаторному увеличению размеров печени, селезенки и лимфатических узлов. В крови увеличивается число лейкоцитов, появляются незрелые формы — нормобласты.
Содержание фосфора и кальция в крови и моче не изменяется. Возможны изменения по типу гипохромной анемии. Следствием изменения строения костного скелета являются деформации лицевого и мозгового черепа, позвоночника, грудной клетки. Может развиваться варусная деформация в проксимальном отделе бедренной кости, галифеобразные искривления диафизов бедренных костей. При появлении гиперостоза скелета в первые годы жизни развивается гидроцефалия как следствие остеосклероза основания черепа; характерны низкий рост, позднее начало ходьбы, ослабление или потеря зрения вследствие сдавливания в костных каналах зрительных нервов, позднее появление островков окостенения эпифизов, задержка прорезывания зубов, которые нередко поражаются кариесом.
Симптомы и признаки
Симптомы гематогенного остеомиелита во многом зависят от того в острой или в хронической форме он протекает. В первом случае болезнь начинается остро, хотя особенности ее клинического течения во многом зависят от возраста больного и пораженной кости. Чаще всего в первый день признаки гематогенного остеомиелита носят системный характер. Наблюдаются:
-
высокая температура тела;
-
озноб;
-
тошнота и рвота;
-
общая слабость;
-
головная боль.
Впоследствии к этому присоединяются местные симптомы в виде выраженных резких болей и отечности пораженной части тела. По мере распространения воспалительного процесса в мягких тканях накапливаются гнойные массы, что приводит к образованию флегмоны. По мере увеличения ее размеров возрастает риск образования свища и выведения гноя наружу.
Характер симптомов острого гематогенного остеомиелита во многом определяются формой его протекания.
Местная форма
Это наиболее легкая форма заболевания. Для нее типично легкое начало и общее течение патологии. В таком случае местные проявления инфекции по выраженности превосходят системные. В первое время наблюдается незначительное повышение температуры тела, после чего присоединяются боли и отечность пораженной части тела, а также остальные местные симптомы. Их выраженность достигает максимума к концу второй недели течения болезни.
При таком течении заболевания важно своевременно вскрыть образовавшийся под надкостницей абсцесс. В противном случае он разрывается, а накопившийся гной проникает в мягкие ткани, что приводит к формированию межмышечной флегмоны
Такие изменения сопровождаются улучшением общего самочувствия больного. Но в то же время это провоцирует переход заболевания в хроническую форму.
Септико-пиемическая форма
Данная форма острого гематогенного остеомиелита отличается более тяжелым течением, чем местная. Уже в первые часы от начала заболевания возникают выраженные общие нарушения с развитием:
-
повышенной температуры тела до 39—40°С;
-
озноба;
-
головных болей;
-
снижения аппетита;
-
рвоты;
-
обезвоживания;
-
бредового состояния.
В части случаев присутствует гемолитическая желтуха.
Кроме того, наблюдается снижение неспецифического иммунитета и повышение свертываемости крови. Это сопровождается быстрым возникновением и нарастанием интенсивности местных симптомов. Больные уже в первые несколько дней начинают страдать от сильных четко локализованных болей, заставляющих держать пораженную конечность в вынужденной позе, избегать не только активных, но и пассивных движений. На фоне этого происходит быстрое нарастание отечности тканей, что свидетельствует об образовании поднадкостничного абсцесса. В случае его прорыва в мягкие ткани наблюдается возникновение явления флюктуации и развития реактивного артрита. Кожа в проекции очага поражения горячая и напряженная. Интенсивность всех этих изменений нарастает в течение 5—10 дней.
Септико-пиемическая форма острого гематогенного остеомиелита опасна генерализацией процесса, т. е. поражением многих других костей скелета из-за распространения с кровью патогенных микроорганизмов из очага поражения.
Токсическая форма
Это самая тяжелая форма гематогенного остеомиелита, в том числе за счет молниеносного развития. Уже в первый день течения заболевания возникает и быстро прогрессирует тяжелый септический шок, что сопровождается:
-
снижением температуры тела;
-
потерей сознания;
-
судорогами;
-
тяжелой слабостью;
-
выраженной сердечно-сосудистой недостаточностью и падением артериального давления.
При этом местные симптомы практически отсутствуют, что значительно осложняет постановку диагноза.
Токсическая форма без раннего адекватного лечения нередко приводит к летальному исходу.
Хронический гематогенный остеомиелит
Переход острого воспалительного процесса в хронический сопровождается улучшением состояния больного, что сопряжено с образованием наружных свищей и костных секвестров. При этом в течение разных отрезков времени наблюдается незначительное по объему отделение гноя из свищевого хода. Иногда в период ремиссии он закрывается полностью.
Но при создании благоприятных условий патогенная микрофлора активизируется и наступает обострение. Это сопровождается характерными для острого остеомиелита симптомами с открытием старых или новых свищей, сквозь которые выходят костные секвестры.
Модификация образа жизни
Лечение и профилактика остеопороза невозможны без изменения образа жизни и избавления от факторов риска этой болезни и ее осложнений
Медикаментозные или другие методы лечения остеопороза важно и нужно дополнять модификацией своего образа жизни
Основные рекомендации Всемирной организации здравоохранения для пациентов с риском остеопоротических переломов:
- ведение постоянного активного образа жизни;
- достаточное пребывание на солнце и на свежем воздухе;
- отказ от табакокурения и избыточного употребления алкоголя;
- соблюдение индивидуальных норм содержания кальция и витамина D в продуктах питания, а в случае необходимости, восполнять дефицит лекарственными препаратами;
- поддерживать индекс массы тела не менее 19 кг/м2, так как низкая масса тела – это серьезный риск переломов;
- соблюдать здоровый режим сна;
- регулярно посещать морские курорты и санатории.
При грамотно составленной лечебной программе, которая будет учитывать все индивидуальные особенности пациента, причину нарушения минерализации костей и факторы риска, а также при адекватных профилактических мероприятиях прогресс остеопороза можно значительно замедлить, а иногда и остановить.































